香港大學李嘉誠醫學院微生物學系研究人員發現冠狀病毒如沙士病毒、中東呼吸綜合症等,皆可反利用人體抗病毒免疫屏障促進自身複製,揭示了為什麼冠狀病毒是非常成功的致病病毒。研究結果已經同行評審,於《自然》雜誌發表,並為治療高致病性冠狀病毒提供了潛在的干預目標,以及可能選擇使用的化合物。
反利用屏障 複製更多病毒
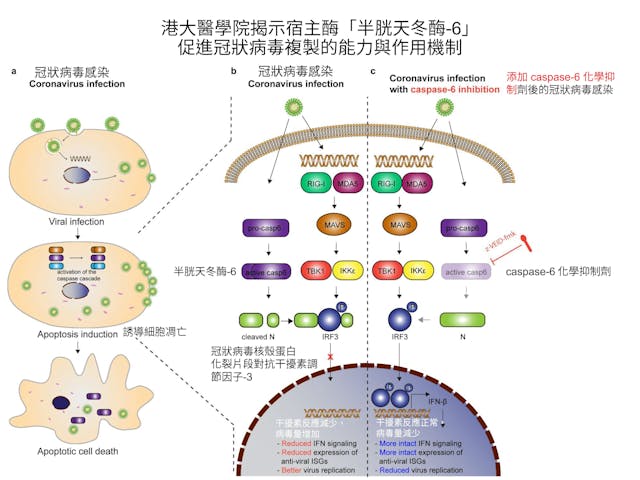
由港大醫學院微生物學系助理教授朱軒博士、臨床副教授陳福和醫生、微生物學系講座教授暨霍英東基金教授(傳染病學)袁國勇博士領導的港大醫學院團隊發現,冠狀病毒可以利用宿主被激活凋亡反應所產生的細胞蛋白酶「半胱天冬酶-6」(caspase-6)進行更有效的複製。而激活凋亡反應是人體對抗病毒感染的第一道天然免疫屏障。
當冠狀病毒進入宿主細胞後,病毒核糖核酸(RNA)會刺激受感染細胞分泌干擾素。干擾素能夠抑制病毒在受感染細胞內的複製,並能降低周圍未感染細胞被其他病毒感染的風險。同時,宿主細胞將經歷凋亡過程,使細胞不會成為生產數百萬病毒的工廠。因此干擾素反應和細胞凋亡反應是人和動物細胞防禦病毒的兩個最重要的機制。
人和動物細胞內的半胱天冬酶-6負責執行細胞凋亡程序,可以通過消除受感染的細胞,從而控制病毒的複製。港大醫學院研究團隊在一系列細胞系、離體肺組織、小腸類器官和動物模型中,發現半胱天冬酶-6抑制劑或半胱天冬酶-6的剔除可有效降低冠狀病毒的複製能力。相反,在過度表達半胱天冬酶-6的細胞中,冠狀病毒的複製能力顯著提高。
抑制劑成效顯著 病毒複製能力弱
在小鼠模型中,半胱天冬酶-6抑制劑顯著降低了MERS-CoV(MERS-CoVMA)的複製能力,小鼠存活率則由33.3%提升至80%。而在半胱天冬酶-6基因已被剔除的小鼠中,MER S-CoV複製能力和引致的肺部損傷水平也顯著降低。同樣地,在倉鼠模型中,半胱天冬酶-6抑制劑顯著降低了SARS- CoV-2複製能力,同時改善了肺部炎症反應和損傷水平。
干擾素反應是宿主細胞最重要和最直接的抗病毒防禦機制。團隊的研究進一步證明,半胱天冬酶-6可裂解冠狀病毒核殼蛋白(nucleocapsid,簡稱N),產生的核殼蛋白片段可以與抗干擾素調節因子-3(Interfe ron Regulatory Factor 3, IRF-3)結合,並阻止其進入細胞核以啟動干擾素反應;通過停止干擾素反應,從而加強病毒的複製能力。