編按:阿爾茨海默氏症(簡稱Alzheimer’s Disease,下稱AD),又稱腦退化症,一直以來都是老年人的惡夢。公開大學5月9日特邀請香港科技大學副校長葉玉如教授主講《從神經科學到人類健康》,分享她與實驗團隊最新有關AD基礎及新療法研究,講座整理如下:
神經細胞運行過程
神經細胞是由神經前體細胞產生的,神經細胞通過連結與其他細胞溝通形成迴路,其中必須是天然去到正確目的地,生出突觸和樹突棘的結構向外擴展,繼而形成非常龐大的網絡──神經網絡。
在胚胎發育時期,如果神經細胞發生問題就會導致神經發育的疾病,例如小腦症,大頭症。研究在胚胎發育的時期改變某一些大腦特定的基因,觀察哪一些腦前葉的結構被改變。例如將訊號改變,就會導致遷移出現缺陷,令神經細胞停留在原本地方,無法到達大腦表層。透過小鼠實驗發現神經細胞異常的情況下很大機會引致癲癇症,自閉症等疾病,由此可見訊號遷移的過程非常重要。透過該實驗我們能了解到某些神經疾病機制是如何發生。
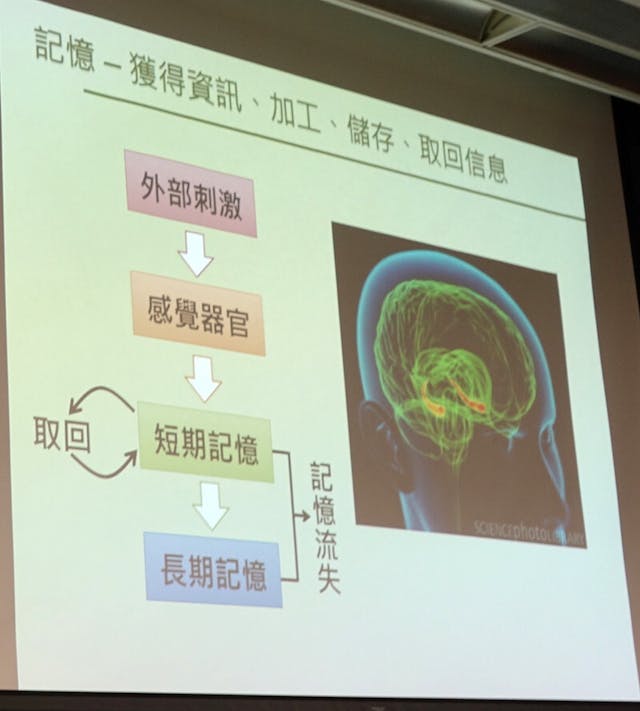
神經細胞與其他神經細胞連接溝通可調控人類不同的行為,包括認知功能。眾所周知,記憶是我們非常重要的一個認知功能,讓我們從獲得資訊,到加工,儲存,取回訊息的一個過程。我們用眼去看,用手去接觸這個世界,用耳去聽,通過這些感覺器官,獲得資訊,暫時儲存在大腦中,作為短期的記憶。當我們重複「獲得資訊」與「儲存」的過程就會成為長期的記憶,例如學生在學習的時候,多次反覆閱讀課本內容,才能牢牢記住所學的知識。
收藏記憶的地方稱為突觸──兩個神經細胞會合、交換記憶的地方。在突觸收到刺激,突觸前的細胞就會釋放神經遞質,然後刺激突觸後的地方。
突觸的重要性
突觸是儲存記憶的地方,樹突棘是突觸的主要位置。當我們學習的時候,突觸是會改變,無論數量,大小,形狀都會產生變化,是可塑性的。有健康的突觸才有正常的神經網絡活動,時間與空間是非常協調的,相反,若突觸發生異常變化,神經網絡亦會發生問題。因此突觸的活動是非常重要。
例如當學習30分鐘後,細胞骨架會產生變化,神經遞質受體會聚集在突觸,然後變大,其傳導亦會增加。然而,當樹突棘一直漲大的時候,是需要一個調節的機制,降低對信號的敏感度,從而維持神經細胞環境的穩定,正常地運作。團隊發現了EphA4受體是調節突觸可塑性的過程,能令突觸由大變小,並且發現EphA4受體的激活降低突觸上神經細胞受體的表達,即是降低突觸的功能,減少神經細胞之間的溝通。這個發現為研究記憶障礙各方面病症及分子機制奠定了重要的基礎,通過基礎研究理解神經發育及可塑性分子細胞機制,例如神經突觸如何調控學習與記憶能力;免疫系統在大腦裏面的作用機制。進一步來說,通過這個基礎研究理解大腦裏病變的機制,以及發現新的斷診及治療方法。
AD阿爾茨海默氏症
AD阿爾茨海默氏症是逐步惡化的疾病,首先是記憶的問題,漸漸就會失去活動的能力,思考與判斷都會產生障礙。病變的時候,突觸是會發生變化,活性會降低,從研究患有AD小鼠腦部可見其樹突棘形狀偏小以及數量也較少。雖然現今AD的病因尚未清楚,但AD患者大腦內的變化已開始有所理解,例如患者腦內會有兩種不正常的沉澱,包括澱粉樣蛋白斑。
全球有三分之一的長者因AD去世,超過85歲的長者超過一半會換上AD,每3秒便會有一個人確診患上AD,現今全球逾5000萬人患有AD,並預計2050年會增加3倍,即有1.5億人的驚人數目。現今所面對的挑戰是患者太遲求診,因為當病徵明顯的前幾年患者大腦已開始發生病變,突觸功能異常往往在早期開始發生。由於AD病因非常複雜,有很多致病的因素尚未理解,而且缺乏客觀診斷工具。所以必須在早期已有可診斷的工具,如生物標誌物,以及有效的干預治療方法。若果AD發病時間延遲5年,預期AD病人的數目可減至一半。

結合基礎研究 探索新治療方法
現時市場上有兩種治療AD的藥物──酯酶ACHE抑制劑(避免ACH被分解)以及NMDA受體拮抗劑(減低過度活化NMDA而引致的毒性),還有一種是以上兩種的組合藥。然而,這些藥物只能針對病徵,卻不能根治。
我們團隊在中藥中找到鉤藤鹼可抑制EphA4受體活性。利用水迷宮測試小鼠空間的記憶能力,透過不同的指示令小鼠學習隱藏平台的位置,從而測試小鼠不同情況下的記憶能力。患有AD的小鼠記憶力明顯比正常的小鼠低,但是,在服用鉤藤鹼後小鼠在平台逗留的時間有所加長,由此可見鉤藤鹼對患有AD的小鼠是有幫助的。實驗結果顯示鉤藤鹼能夠恢復神經細胞之間溝通以及學習能力,因此有潛力成為治療AD的藥物。
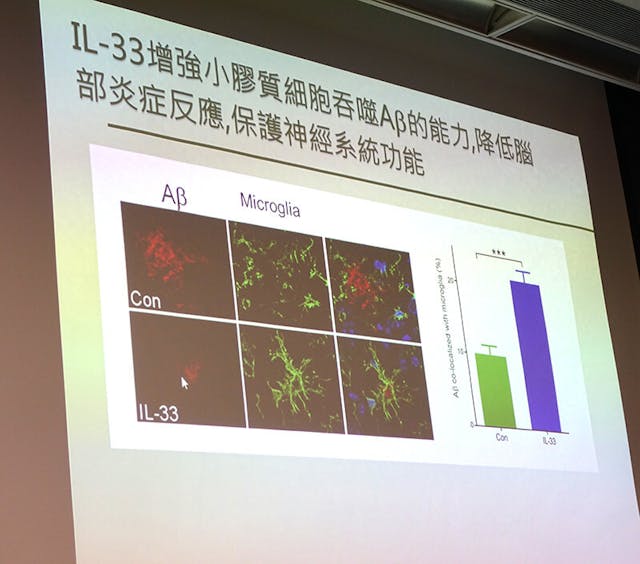
免疫細胞失調可以是新的AD治療靶點。在大腦中除了神經細胞之外,還有大腦免疫細胞──小膠質細胞,作用是清除大腦裏面的Aβ。每個人體都存在白介素-33(1L-33)免疫蛋白,能在人體受損後發出警報,提醒啟動修復過程,若果1L-33的基因表達降低,就會導致患上AD。原理是1L-33經過受體ST2結合,使到神經細胞有正常的功能。然而,ST2有另外一個可溶性的soluble ST2 (sST2)也可以與1L-33結合令到ST2獨立出來,從而無法發揮正常功能。在輕度認知障礙症患者也發現大腦中的sST2增加。換言之sST2是1L-33的抑制劑。實驗團體將1L-33注射到患有AD小鼠身上,結果在兩天之後小鼠記憶能力有明顯改善,神經細胞能力已被修復,同時發現小鼠腦中已減少澱粉樣蛋白斑數量。通過這項研究確定Aβ所形成的澱粉樣蛋白斑是導致AD的關鍵因素,而透過注射1L-33增強小膠質細胞,從而能夠吞噬澱粉樣蛋白斑,降低腦部炎症反應,保護神經系統功能,達到治療AD的效果。
中醫藥的小分子鉤藤鹼以及1L-33調節免疫細胞失調的新研究療法例子已進入臨床實驗,若然結果正面,將正式用以治療AD患者。現今診斷方式主要依賴病人病史,認知功能檢測以及醫生的臨床經驗,是缺乏客觀及量化依據,往往AD發展到後期才確診,最好干預方法是在突觸受損的前期,因此我們需要尋找方法在病發早期確診AD及進行正確的治療方法,例如開發生物標誌物。
首個針對中國AD人群的研究
基因是其中一種獨特的生物標誌物,基因的突變與之後功能的變化是疾病產生的重要因素。現時已經發現DNA的突變是與AD發病是有關的,帶有這個發病的分子標記人士患病風險是較高的。其中遺傳的風險因子包括ApoE4是重要的高風險因素,帶有ApoE4風險因子人士患病機會是比正常人高出15倍。但是ApoE4並非患病的唯一因素,現時主流的基因組合研究全部集中在高加索人群——西方白人,缺乏對中國人群的研究,因此我們需要研究中國人群的生物標誌物。實驗團隊與內地、香港醫生合作對中國人群進行全基因測聚和數據分析的有系統研究,從大資料中分析出遺傳風險的因子。這是為第一個完成針對中國AD人群全基因組測試的研究。新的遺傳風險因素以及與病變相關的信號,建立模型捕捉多基因在病變中作用的模式,對個體AD風險進行評分──低風險,中風險,高風險。為了建立更多風險評估模型與疾病檢測模型,團隊將會繼續發掘更多AD的生物標誌物。
同時人猿幹細胞模型iPSC(induced pluripotent stem cells 誘導性多能幹細胞)亦已被建立,用基因編輯的技術將iPSC變成為帶突變基因,在AD患者血液或皮膚組織建立iPSC系統,將幹細胞培養成為神經細胞,通過藥物篩選找到候選靶向藥物,向精準醫學方向發展。







































